Reversibilità della Sindrome di Dravet
Sottomessi i primi risultati per una pubblicazione.Intervista alla dott.ssa Gaia Colasante- finanziamento bando 2019 |
|
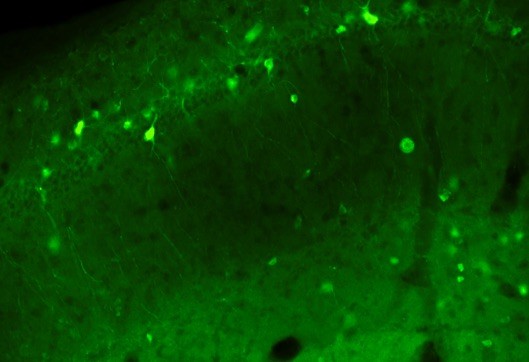
Negli ultimi sei mesi, ci siamo dedicati interamente alla conclusione degli esperimenti del progetto di ricerca che ha come obiettivo la comprensione della reversibilità della sindrome di Dravet, una volta che l’espressione fisiologica del gene Scn1a viene ripristinata, in modelli di topo che presentano già i sintomi della malattia. Questo progetto è cominciato circa cinque anni fa. Quando il primo articolo relativo ad uno studio è pronto per essere sottoposto al processo di revisione scientifica, è sempre entusiasmante guardare indietro a tutti i diversi passaggi, le difficoltà e le sfide che abbiamo dovuto fronteggiare nel corso degli anni. Cinque anni fa, abbiamo cominciato a pensare alla strategia genetica per generare il modello reversibile della sindrome di Dravet e abbiamo cominciato i clonaggi per il costrutto di DNA, utile per modificare il locus genomico del gene Scn1a. Il primo grande risultato è stato l’ottenimento dei primi due topolini chimerici: le chimere sono composte da due tipi di cellule con un diverso profilo genetico, alcune “normali” and altre che hanno un segnale di STOP inserito nel gene Scn1a e che lo rende silente, ovvero interferisce con la sua espressione. Con questi topolini, abbiamo fondato l’intera colonia del topo reversibile Dravet. Eravamo molto in ansia di analizzare i primi animali, per confermare che presentassero i sintomi tipici dei modelli Dravet. Ricordo ancora il giorno in cui Nicholas Valassina, che a quel tempo era studenet di tesi nel laboratorio, mi ha telefonato dallo stabulario dicendo: “Gaia, credo di aver appena visto una crisi spontanea mentre cambiavo le gabbie ai topolini Dravet reversibili”. Era finalmente la prima prova che il segnale di STOP che avevamo inserito nel gene Scn1a stesse funzionando correttamente. Ancora piu’ incoraggiante fu l’evidenza che in questi animali potevamo ripristinare con efficienza i livelli normali del canale al sodio Nav1.1. Ciò voleva dire che con questo modello animale potevamo mimare una terapia ottimale basata sull’aumento dei livelli della proteina Nav1.1 e quindi studiare la reversibilità sintomatica. Eravamo contenti perchè sapevamo che questo topolino avrebbe potuto essere molto utile per i pazienti e per la comunità scientifica che lavora sulla sindrome di Dravet. Negli anni a seguire abbiamo lavorato sodo per ottenere tutte le informazioni sulla reversibilità sia delle crisi epilettiche che delle alterazioni comportamentali che caratterizzano gli animali Dravet. E negli ultimi mesi, grazie all’esperienza del Dr. Simone Brusco, che è l’elettrofisiologo del gruppo, abbiamo potuto analizzare anche in che modo l’attività neuronale cambia negli interneuroni GABAergici Dravet, che sono quelli maggiormente alterati e, cosa accade nel loro funzionamento quando ripristiniamo i livelli di Nav1.1 in queste cellule neuronali. La pandemia del Coronavirus ha tentato di rallentare e di fermare il nostro lavoro, ma noi siamo stati piu’ forti e piu’ motivati! Dopo la conclusione degli esperimenti, abbiamo impiegato ancora due mesi per scrivere completamente l’articolo per la pubblicazione: i lavori scientifici sono sempre più complessi e sono richieste molte competenze per spiegare e dimostrare ogni singola ipotesi in maniera convincente. Infine, il nostro lavoro è stato inviato per essere considerato per la pubblicazione su una importante rivista scientifica internazionale e siamo ora in attesa di ricevere i commenti di altri scienziati, i revisori, che valuteranno i nostri esperimenti e i relativi risultati ottenuti. [Figura 1: Il Dr. Simone Brusco che lavora al suo set-up di elettrofisiologia per analizzare l’attività delle cellule neuronali.][Figura 2: Gli interneuroni GABAergici che esprimono la proteina verde GFP nell’ippocampo dei topolini Dravet.]LINK AL BANDO 2019 |
Reversibility of Dravet Syndrome: first results submitted for publication.
Interview with Dr. Gaia Colasante - Research Grant 2019
During the last six months, we have been focused on the conclusion of the last experiments of the project aiming to assess the reversibility of Dravet Syndrome once that physiological expression of Scn1a gene is restored in murine models already symptomatic.
This project started almost five years ago. When the first publication related to a study is ready to be sent out for the peer review process, it is always exciting looking back at the all the different steps, difficulties and challenges we had to face along the years.
Five years ago, we thought about the genetic strategy to generate the reversible Dravet mouse model we started the cloning work to make the DNA construct for the modification of the genomic locus of Scn1a gene. The first great achievement was when the first two murine chimeras were born: chimeras are mice composed by two genetically distinct cell types, that are “normal” cells and other cells that have Scn1a locus with inserted a STOP cassette that makes one copy of the gene silent. Starting from those two mice, we founded the colony of the Dravet reversible mouse model. We were really anxious to analyze the first mice to be sure that they were well recapitulating the main features of Dravet syndrome. I still remember the day in which Nicholas Valassina, who at that time was a master student in the lab, phoned me from the mouse facility saying: “Gaia, I think I jave just seen a spontaneous seizure while I was changing the cages to the reversible Dravet mice”. That was the first prove that the STOP cassette we had inserted in the Scn1a locus was working properly.
Even more confidence came when we saw that in these mice we could efficiently restore the levels of Nav1.1 protein. This meant that with this murine model, we could mimic an optimal treatment based on restoration of Nav1.1 channel level and therefore explore efficiently reversibility in Dravet mice. We were happy because we knew that that model could be very helpful for patients and for the scientific community working on Dravet syndrome.
In the next years we worked hardly to get all the information with different experiments aiming to assess reversibility both in terms of seizure and behavioral alterations characteristic of Dravet mice.
And in the last months, thanks to the experience of Dr. Simone Brusco, who is the electrophysiologist of the team, we could also analyze how the neuronal activity changes in Dravet GABAergic interneurons, the main neurons affected in Dravet syndrome and, most importantly, what happens to them when we restore Nav1.1 channel in those neuronal cells.
The coronavirus pandemic tried to slow down and stop our work, but we were stronger and even more motivated!
Neverthless, after the conclusion of the experiments, we took about two extra months to write the manuscript: scientific works are more and more complex, and many competences are required to explain and demonstrate convincingly every single hypothesis. Finally, our work has been sent for consideration of publication in an important journal and we are now waiting for the comments of other scientists, the reviewers, on our experiments and results.